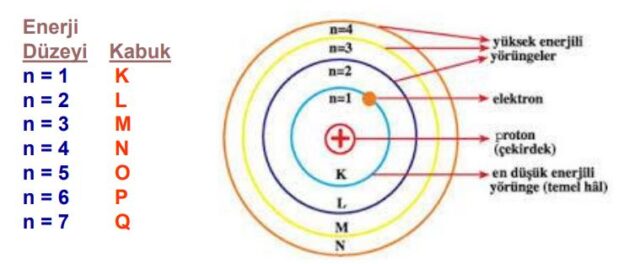
Temel enerji düzeyi, atomların elektronlarının bulunabileceği enerji seviyelerinin en düşük seviyesidir. Atomlar, elektronları çekirdeğin etrafında yörüngelerinde dolaşan parçacıklardan oluşur. Elektronlar belirli enerji seviyelerinde bulunabilir ve bu seviyeler kabaca enerji merdiveni gibi düşünülebilir.
Temel enerji düzeyi, en düşük enerji seviyesidir ve genellikle “n=1” olarak gösterilir. Bu düzeydeki elektronlar, atomun en iç yörüngesinde bulunur ve en az enerjiye sahiptirler. Bu seviyede elektronlar, çekirdeğe daha yakın bir konumda bulunurlar.
Atomlar, uygun enerji alır veya verirlerse elektronlarını daha yüksek enerji seviyelerine geçirebilir veya temel enerji düzeyine geri dönebilirler. Elektronlar, enerji emme veya yayma yoluyla enerji seviyeleri arasında geçiş yapabilir ve bu geçişler ışığın emisyonu veya absorpsiyonu şeklinde görülebilir.
Temel enerji düzeyi, atomların kimyasal bağlanma, spektroskopi ve diğer fiziksel olaylarla ilgili davranışını anlamak için önemli bir kavramdır.
Temel Enerji Düzeyi Sayısı Nedir?
Temel enerji düzeyi sayısı atomun yapısına bağlı olarak değişir. Atomlarda, temel enerji düzeyleri, elektronların bulunabileceği ve enerji seviyelerinin sayısal bir göstergesi olan “n” değeri ile tanımlanır. Genel olarak, bir atomun temel enerji düzeyi sayısı, elektronların en yüksek temel enerji düzeyinde bulunabilecekleri maksimum “n” değeriyle ifade edilir.
Bohr atom modeline göre, elektronlar çekirdek etrafında belirli yörüngelerde bulunur ve enerji seviyeleri “n=1, 2, 3, …” şeklinde artar. Ancak modern kuantum mekaniği, daha karmaşık bir yapıya sahip olduğunu ve elektronların belirli orbitallere dağıldığını gösterir.
Örneğin, hidrojen atomu için temel enerji düzeyleri “n=1, 2, 3, 4, …” şeklinde sıralanır. Dolayısıyla, hidrojen atomunun temel enerji düzeyi sayısı sonsuzdur.
Ancak, elektron doluş kuralları ve enerji seviyelerinin doluluğu, elektronların yerleşebileceği temel enerji düzeylerinin belirli bir sınıra sahip olduğunu gösterir. Örneğin, birinci enerji düzeyi (n=1) en fazla 2 elektron alabilirken, ikinci enerji düzeyi (n=2) en fazla 8 elektron alabilir. Dolayısıyla, her atomun temel enerji düzeyi sayısı, elektron dizilimine bağlı olarak değişir.
Atomun Katman Sayısı Nasıl Bulunur?
Atomun elektron katman sayısı, atomun elektron dizilimine ve yapısına bağlı olarak belirlenir. Elektronların atomun çekirdeği etrafındaki yörüngelerdeki dağılımı atomun katman yapısını oluşturur.
Elektron katman sayısı, genellikle atomun enerji seviyeleri olan temel enerji düzeylerinin sayısını ifade eder. Kuantum mekaniği, elektronların belirli enerji seviyelerine yerleştiğini ve bu enerji seviyelerini kabaca “n=1, 2, 3, …” şeklinde tanımlar.
Elektron katman sayısı, elektronların en dış enerji seviyesinde bulunan temel enerji düzeyinin sayısıdır. Bir atomun elektron katman sayısı, en dış enerji seviyesindeki temel enerji düzeyinin “n” değerini gösterir.
Örneğin, bir hidrojen atomu, tek bir elektronla en dış enerji seviyesinde (n=1) yer aldığı için elektron katman sayısı 1’dir. Bir lityum atomu ise, 3 elektronla en dış enerji seviyesinde (n=2) bulunur, bu nedenle elektron katman sayısı 2’dir.
Atomun elektron dizilimini ve doluş kurallarını anlamak, elektronların enerji seviyelerine ve doluluğuna göre elektron katman sayısını belirlemek için önemlidir. Bu, atomun elementine ve atom numarasına bağlı olarak değişir ve ilgili kimya kaynakları veya periyodik tablo gibi kaynaklar bu bilgilere ulaşmanızı sağlayabilir.