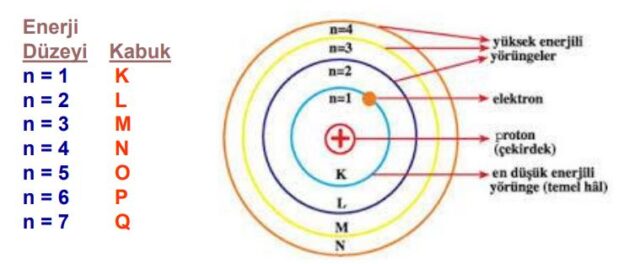
Temel enerji düzeyi, atomik yapıdaki elektronların enerji seviyelerini ifade eden bir kavramdır. Atomların çekirdeğinde yer alan protonlar ve nötronlar, elektronları çekerek atomun etrafında dairesel yörüngelerde dönmesine neden olur. Her yörünge veya enerji seviyesi, elektronların belirli bir enerjiye sahip olduğu ve belirli bir uzaklıkta atom çekirdeğinden bulunduğu düşünülen kabul edilen bir düzenlemeyi temsil eder.
Atomlar, temel enerji düzeylerindeki elektronları doldurarak daha kararlı bir duruma ulaşmaya çalışırlar. Elektronlar, en düşük enerji seviyesinden başlayarak, yani temel enerji düzeyinden yukarı doğru doldurulur. Bu enerji düzeyleri, kabaca elektron kabukları olarak adlandırılan K, L, M, N, vb. harflerle ifade edilir. Her enerji düzeyi belirli bir elektron sayısını kabul eder ve daha yüksek enerji düzeylerine geçmek için elektronlar enerji alarak veya emerek daha dış yörüngelere taşınabilir.
Temel enerji düzeyleri, atomların kimyasal bağlarını ve spektral özelliklerini etkileyen önemli bir faktördür. Elektronların enerji düzeyleri, atomların kimyasal tepkimelerde diğer atomlarla etkileşimlerini belirler ve ışık emisyonu ve absorpsiyonu gibi elektronların enerji seviyelerindeki değişiklikler, spektral analizlerde kullanılır.
Temel enerji düzeyi nerede kullanılır?
Temel enerji düzeyi kavramı, fizik ve kimya alanlarında yaygın olarak kullanılır. İşte temel enerji düzeyinin bazı önemli kullanım alanları:
- Atomik ve Moleküler Fizik: Atomlar ve moleküllerin enerji düzeyleri, atomik ve moleküler fizik alanında incelenir. Elektronların enerji düzeyleri, atomların spektral özelliklerini, ışık absorpsiyonu ve emisyonunu, kimyasal tepkimeleri ve elektron geçişlerini açıklamada kullanılır.
- Kimya: Kimyada, atomların elektron yapıları ve enerji düzeyleri, kimyasal bağlar, reaktivite ve moleküler özellikler üzerinde büyük bir etkiye sahiptir. Temel enerji düzeyleri, elektron dağılımını ve kimyasal tepkimelerin nasıl gerçekleştiğini anlamak için kullanılır.
- Spektroskopi: Elektronik enerji düzeyleri, spektroskopi çalışmalarında önemli bir rol oynar. Elektronların enerji düzeyleri, ışığın absorbe edildiği veya yayıldığı dalga boylarını ve spektral özelliklerini belirler. Bu bilgiler, spektroskopik analizlerde element tespiti, moleküler yapıların belirlenmesi ve madde özelliklerinin incelenmesi için kullanılır.
- Kuantum Mekaniği: Kuantum mekaniği, atom ve moleküllerin davranışını açıklamak için kullanılan bir fizik teorisi. Kuantum mekaniği, elektronların enerji düzeylerini, dalga fonksiyonlarını ve olasılık dağılımlarını temel alır. Temel enerji düzeyleri, kuantum mekaniği prensiplerine dayanarak atomik ve moleküler sistemlerin matematiksel modellemesinde kullanılır.